किसी जीवित ऊतक में उपस्थित सभी कार्बनिक पदार्थो को सामूहिक रूप से जैव अणु कहा जाता है।
जीवित ऊतक में कार्बनिक यौगिक के साथ-साथ अकार्बनिक यौगिक भी पाए जाते है।
विभिन्न यौगिको को प्रथक करने के लिए प्रथक्करण विधि को काम में लिया जाता है।
किसी भी यौगिक के आण्विक सूत्र और सरंचना का पता लगाने के लिए विश्लेषणात्मक तकनीक का
उपयोग किया जाता है।
तत्वीय विश्लेषण से किसी जीव ऊतक के तत्त्वीय संगठन आदि की जानकारी प्राप्त होती है।
यौगिक परीक्षण से जीव ऊतक में उपस्थित कार्बनिक और अकार्बनिक यौगिक के बारे में जानकारी
प्राप्त होती है।
रसायन विज्ञान में यौगिक को क्रियात्मक समूह जैसे एल्डीहाइड, कीटोन, ऐरोमैटिक यौगिक आदि की
पहचान होती है किंतु जीव विज्ञान में इन्हे अमीनो अम्ल, न्यूक्लीयोटाईड क्षार, वसा अम्ल आदि में
वर्गीकृत करते है।
सजीव और निर्जीव दोनो ही विभिन्न तत्वों से मिलकर बने होते है।
किसी जीव ऊतक में प्रति इकाई में इन तत्वों की मात्रा अलग अलग होती है।
प्राणी जगत में प्रचुरता से पाया जाने वाला प्रोटीन-कोलेजन प्रोटीन
सम्पूर्ण जैव मंडल में सर्वाधिक प्रचुरता म मिलने वाला प्रोटीन-रूबिस्को (राइबुलोज बिसफोस्फेट
कार्बोक्सिलेज ऑक्सीजीनेज)
जैव अणु (Biomolecules) के रासायनिक संगठन का विश्लेषण
Table of Contents
जीवों में कार्बनिक यौगिक किस रूप में मिलते है यह पता लगाने के लिए यौगिक के रासायनिक
संगठन का विश्लेषण किया जाता है।
सजीव ऊतक (सब्जी या यकृत का टुकड़ा)
⇓
ट्राई क्लोरोएसिटिक अम्ल में डालकर खरल और मूसल की सहायता से पीसते है।
⇓
गाढ़ा कर्दम प्राप्त होता है
⇓
महीन कपडे से छानते है
⇓
दो अंश प्राप्त होते है
⇓ ⇓
अम्ल विलेयशील अंश (निस्यंद)
कई सारे कार्बनिक पदार्थ और
अकार्बनिक यौगिक जैसे सल्फेट
फॉस्फेट आदि मिलते है।
तत्व | प्रतिशत भार | |
भू -पर्पटी | मानव शारीर | |
H | 0.14 | 0.5 |
C | 0.03 | 18.5 |
O | 46.6 | 65.0 |
N | बहुत कम | 3.3 |
S | 0.03 | 0.3 |
Na | 2.8 | 0.2 |
Ca | 3.6 | 1.5 |
Mg | 2.1 | 0.2 |
Si | 27.7 | नगण्य |
अम्ल अविलेयशील अंश (धारित)
जीव ऊतक में उपस्थित अकार्बनिक अवयव
सोडियम Na+ पोटेसियम K+ कैल्सियम Ca2+ मैग्नेसियम Mg2+ जल H2O यौगिक NaCl, CaCO3, PO43-, SO42-
|
अकार्बनिक तत्व और यौगिक का परिक्षण - भंजक प्रयोग
जीव ऊतक (पर्ण या यकृत का टुकड़ा)
⇓
भार तौलते है (नम भार)
⇓
सूखाते है
⇓
सम्पूर्ण जल वाष्पित हो जाता है
⇓
भार तौलते है
⇓
शुष्क भार
⇓
जलाते है
⇓
कार्बनिक यौगिक ऑक्सीकृत होकर
⇓
CO2 और वाष्प के रूप में अलग हो जाते है
⇓
भस्म
⇓
इसमें अकार्बनिक तत्व पाए जाते है
जैसे SO42-, PO43-
अमीनो अम्ल
- ये कार्बनिक यौगिक होते है जो आपस में पेप्टाइड बंध का निर्माण कर प्रोटीन बनाते है।
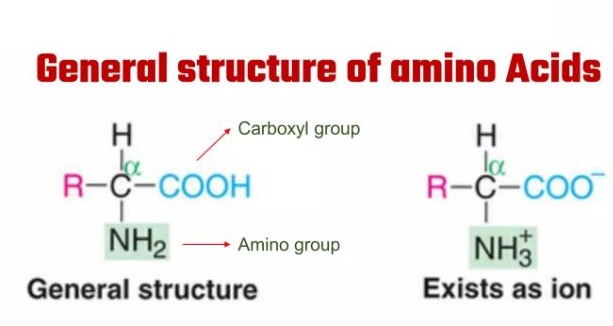
- अमीनो अम्ल में एक ही कार्बन पर एक अमीनो समूह और एक अम्लीय समूह प्रतिस्थापित होता है इसलिए इन्हे एल्फा अमीनो अम्ल भी कहा जाता है और इसमें उपस्थित कार्बन को एल्फा कार्बन कहते है।
- ये प्रतिस्थापी मेथेन होते है जिसमे चार प्रतिस्थापी समूह कार्बन के चार सयोंजकता स्थल से जुड़े होते है। ये समूह H, कार्बोक्सिल समूह, अमीनो समूह और भिन्न परिवर्तनशील समूह (R समूह) होते हैै।
- अमीनो अम्ल स्वास्थ्य के लिए आवश्यक होते है जिनकी आपूर्ति खाद्य पदार्थ के द्वारा होती है।
- आहार में उपस्थित प्रोटीन ही इन अमीनो अम्ल का स्त्रोत होता है।
- अमीनो अम्ल दो प्रकार के होते है –
1. अमीनो अम्ल – ये शरीर में नही बनते है, इनकी आपूर्ति खाद्य पदार्थ से होना आवश्यक है।
2. अनावश्यक अमीनो अम्ल – इनका निर्माण शरीर में हो जाता है, इसलिए इनकी उपस्थिति खाद्य पदार्थ में आवश्यक नहीं है। - R समूह की प्रकृति के आधार पर अमीनो अम्ल कई प्रकार के होते है फिर भी प्रोटीन में उपलब्धता के आधार पर 20 प्रकार के अमीनो अम्ल होते है।
- अमीनो अम्ल में भौतिक और रासायनिक गुण मुख्यतर: अमीनो समूह, कार्बोक्सिल समूह और R क्रियात्मक समूह पर निर्भर होते है।
- अमीनो समूह और कार्बोक्सिल समूह की संख्या के आधार पर अमीनो अम्ल
(i) अम्लीय अमीनो अम्ल – ऋणात्मक आवेशित – ग्लूटामिक अम्ल
(ii) क्षारीय अमीनो अम्ल – धनात्मक आवेशित – लाइसिन
(iii) उदासीन अमीनो अम्ल – वेलिन
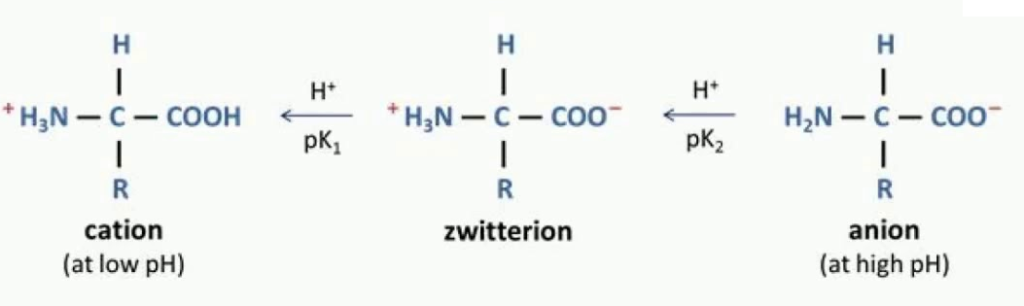
(iv) एरोमेटिक अमीनो अम्ल – टायरोसिन, ट्रिप्टोफेन, फेनिल एलानिन आदि - अमीनो अम्ल में अमीनो समूह और कार्बोक्सिल समूह आयनीकरण प्रकृति के होते है अतः भिन्न pH वाले विलयन में अमीनो अम्ल की सरंचना परिवर्तित होती है।
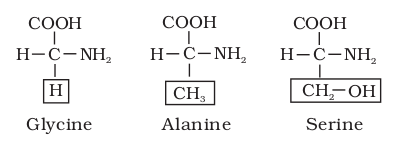
यदि R =H तो अमिनो अम्ल = ग्लाइसिन
यदि R =CH3 तो अमिनो अम्ल = ऐलानिन
यदि R =CH2OH तो अमिनो अम्ल = सीरीन
प्रोटीन
ये अमीनो अम्ल के विषमबहुलक होते है क्योंकि प्रोटीन में 20 प्रकार के अमीनो अम्ल पाए जाते है।
प्रोटीन अमीनो अम्ल की लड़ियों से बने होते है और अमीनो अम्ल के मध्य पेप्टाइड बंध पाया जाता है।
प्रोटीन की सरंचना
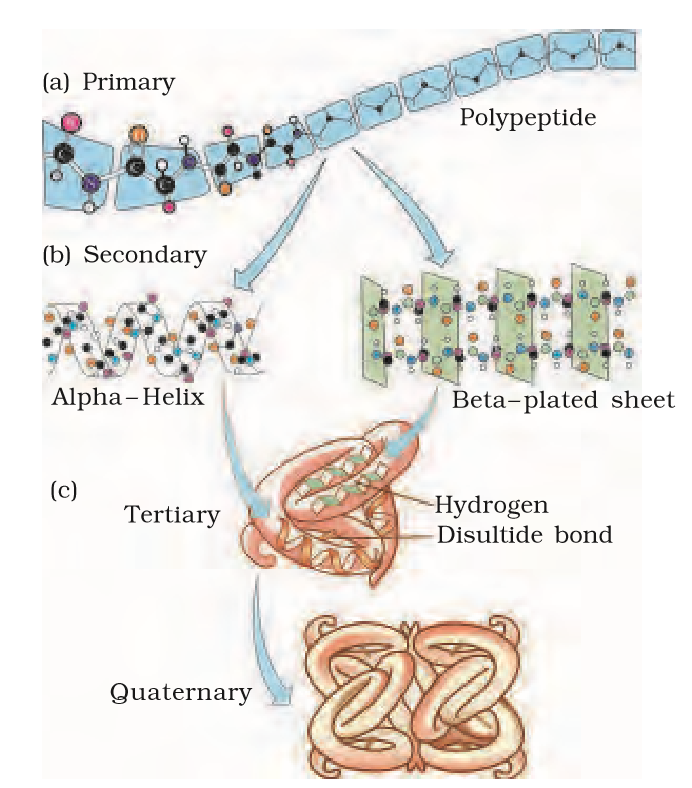
1. प्राथमिक सरंचना
प्रोटीन की वह सरंचना जिसमे किसी पॉलीपेप्टाइड श्रंखला में अमीनो अम्लो के रेखीय अनुक्रम को दर्शाया जाता हैै उसे प्रोटीन की प्राथमिक सरंचना कहते है।
इस सरंचना में प्रोटीन में अमीनो अम्ल के क्रम और उसके स्थान के बारे में जैसे की पहला, दूसरा, तीसरा व इसी प्रकार अन्य कौन सा अमीनो अम्ल होगा इसकी जानकारी प्राप्त होती है।
इस सरंचना में केवल पेप्टाइड बंध पाए जाते है।
श्रंखला में प्रथम अमीनो अम्ल को नाइट्रोजन सिरा अमीनो अम्ल और अंतिम अमीनो अम्ल को कार्बन सिरा अमीनो अम्ल कहा जाता है।
2. द्वितीयक सरंचना
जब प्रोटीन की प्राथमिक सरंचना का कुछ भाग मुड़कर कुंडली के रूप में व्यवस्थित होकर सरंचना बनाता है तो उसे प्रोटीन की द्वितीयक सरंचना कहते है।
ये दो प्रकार की होती है अल्फा हेलिक्स और बीटा प्लेटेड शीट।
प्रोटीन में केवल दक्षिणावृत कुंडलियां मिलती है।
3. तृतीयक सरंचना
जब प्रोटीन की लड़ी अपने ऊपर ही कुंडलित होकर एक खोखले ऊन के समान गोले जैसी सरंचना का निर्माण करे तो उसे प्रोटीन की तृतीयक सरंचना कहते है।
यह सरंचना प्रोटीन के त्रिआयामी दृश्य को प्रदर्शित करती है।
प्रोटीन की यह सरंचना प्रोटीन के जैविक क्रियाकलापों के लिए आवश्यक होती है।
इस सरंचना में पेप्टाइड बंध, हाइड्रोजन बंध और डाई सल्फाइड बंध पाए जाते है।
4. चतुष्क सरंचना
कुछ प्रोटीन एक से अधिक पॉलीपेप्टाइड या उप इकाइयों से मिलकर बने होते हैए जिसमे प्रत्येक पॉलीपेप्टाइड या उपइकाई एक दूसरे के सापेक्ष विशेष रूप से व्यवस्थित होती है। जैसे गोले की सीधी लड़ी, एक दूसरे के ऊपर गोले व्यवस्थित होकर घनाभ या पट्टिका की सरंचना आदि।
चतुष्क सरंचना प्रोटीन के स्थापत्य को प्रदर्शित करती है।
उदाहरण – वयंस्क मनुष्य में हीमोग्लोबिन की सरंचना जो चार उपइकाइयों से मिलकर बनी होती है। (α2β2)
प्रोटीन के कार्य
(I) अंतर कोशिकीय भरण पदार्थ – कोलेजन
(II) एंजाइम – ट्रिप्सिन
(III) हार्मोन – इंसुलिन
(IV) संक्रमण से लड़ना – प्रतिजीव
(V) संवेदना ग्रहण – ग्राही
(VI) कोशिका में ग्लूकोज का परिवहन – GLUT4
नोट :-
अणुओं की सरंचना का अर्थ विभिन्न संदर्भ में अलग अलग होता है।
अकार्बनिक रसायन में सरंचना का संबंध आण्विक सूत्र से होता है जैसे NaCl, KOH आदि
कार्बनिक रसायन विज्ञानी अणुओं की रचना के द्विआयामी दृश्य को व्यक्त करते है।
भौतिक विज्ञानी आण्विक रचना के त्रिआयामी दृश्य को व्यक्त करते है।
वसा
जल में अघुलनशील
वसा निम्न रूपों में पाई जाती है –
(I) साधारण वसा अम्ल
वसा अम्ल कार्बोक्सिल अम्ल होते है जिसमे एक R समूह होता है।
R समूह मेथिल, एथिल या उच्च संख्या वाले -CH2 समूह (1 से 19 कार्बन) वाले होते है।
उदाहरण पाल्मिटिक अम्ल 16 कार्बन युक्त व ऐरेकीडोनिक अम्ल 20 कार्बन युक्त
वसा अम्ल दो प्रकार के होते है
संतृप्त वसा अम्ल – ये बिना द्विबंध वाले होते हैं।
असंतृप्त वसा अम्ल – एक या अधिक C=C द्विबंध युक्त
जैसे – पाल्मिटिक अम्ल CH3-(CH2)14-COOH
(II) साधारण वसा
उदाहरण ग्लिसराल या ट्राई हाइड्रॉक्सी प्रोपेन
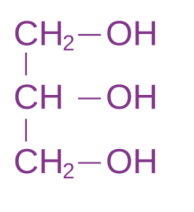
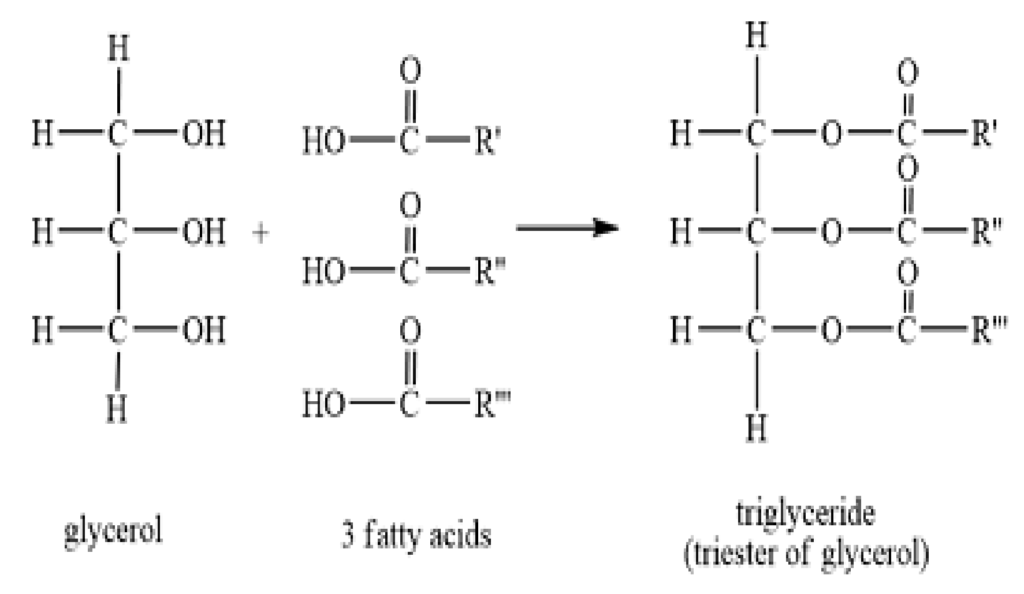
(III) ग्लिसरॉल और वसा अम्ल युक्त वसा
इसमें वसा अम्ल ग्लिसरॉल से एस्ट्रीकृत होता है।
ये तीन प्रकार के होते है-
A मोनो ग्लिसरॉइड्स – वसा अम्ल+ ग्लिसरॉल
B डाई ग्लिसरॉइड्स – 2 वसा अम्ल+ग्लिसरॉल
लिपिड
गलन बिंदु के आधार पर
तेल
गलन बिंदु – कम
कमरे के ताप पर – द्रव्य अवस्था
असंतृप्त वसा अम्ल युक्त सं
उदाहरण जिन्जेली तेल
वसा
गलन बिंदु – ज्यादा
कमरे के ताप पर – सामान्यतया ठोस
संतृप्त वसा अम्ल युक्त
- नोट
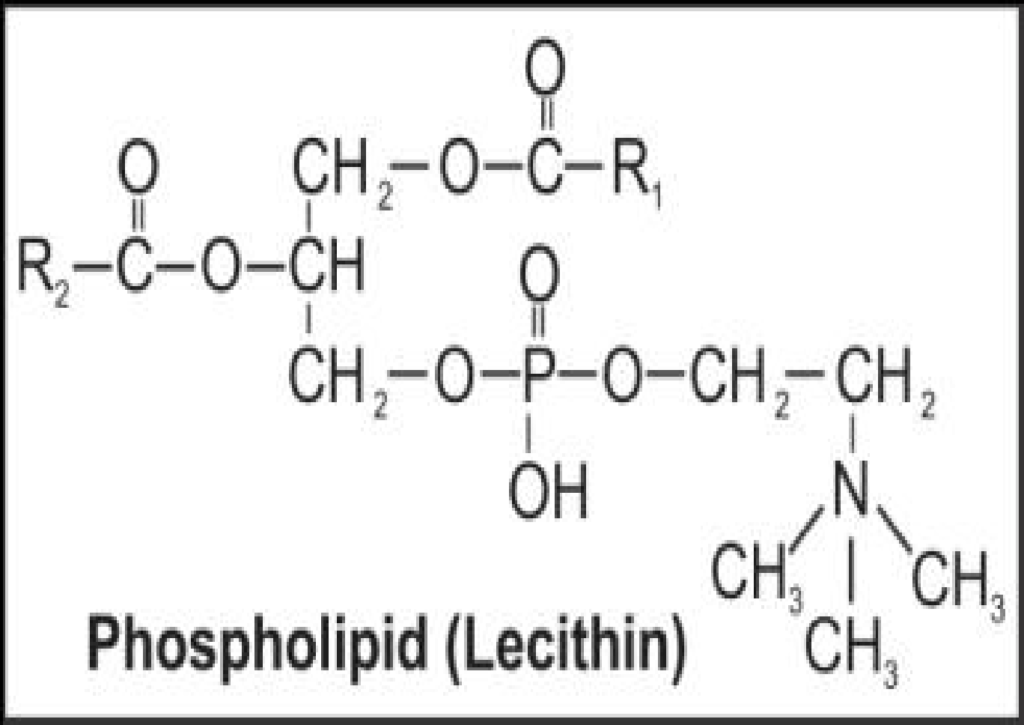
- कुछ लिपिड में फॉस्फोरस व एक फॉस्फोरीलीकृत कार्बनिक यौगिक मिलता है उन्हें फॉस्फोलिपिड कहा जाता है। जैसे कोशिका झिल्ली में उपस्थित लेसिथिन
- तंत्रिका तंत्र में अधिक जटिल सरंचना युक्त लिपिड पाए जाते है।
नाइट्रोजन क्षार
ये विषम चक्रीय वलय युक्त कार्बनिक यौगिक होते है।
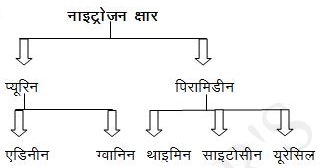

न्यूक्लिक अम्ल –
- न्यूक्लिक अम्ल न्यूक्लिओटाइड के बहुलक होते है।
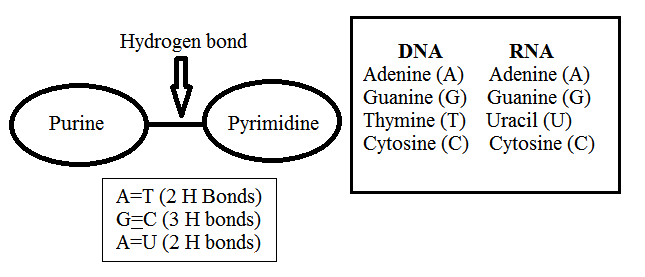
- सजीवों में दो प्रकार के न्यूक्लिक अम्ल पाए जाते है-डीऑक्सीराइबो न्यूक्लिक अम्ल DNA व राइबोन्यूक्लिक अम्ल RNA
- ये एक वृहत अणु है जो ऊतक के अम्ल अविलेयशील अंश में पाए जाते है।
- ये पॉली न्यूक्लिओटाइड होते है।
- न्यूक्लिक अम्ल पॉलीसेकेराइड और पॉलीपेप्टाइड से जुड़कर ऊतक या कोशिका का वास्तविक वृहत आण्विक अंश बनाते हैं।
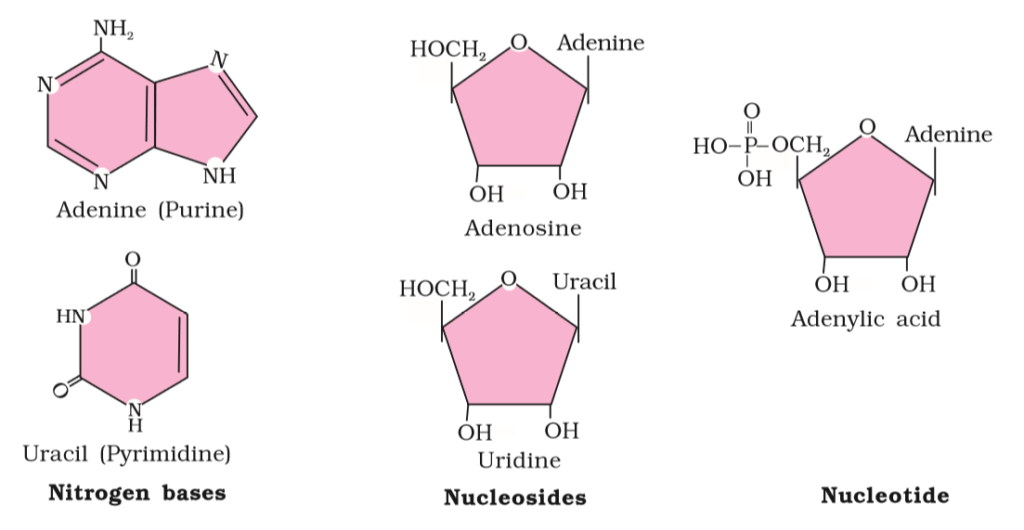
- एक न्यूक्लिओटाइड तीन भिन्न रासायनिक घटकों से मिलकर बना होता है पहला विषम चक्रीय यौगिक, दूसरा मोनोसैकेराइड व तीसरा फॉस्फोरिक अम्ल या फॉस्फेट होता है।
- न्यूक्लिक अम्ल में विभिन्न प्रकार की द्वितीयक सरंचना मिलती है।
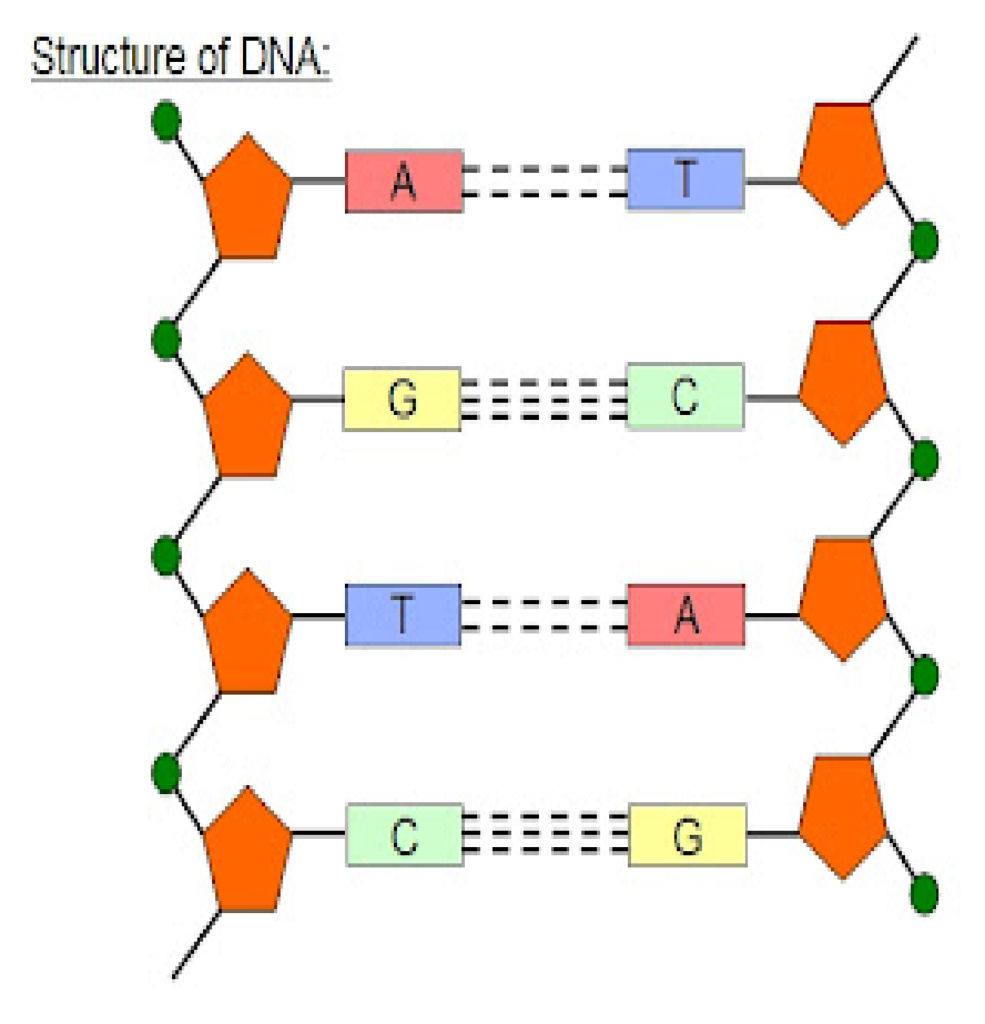
- वॉटसन और क्रिक द्वारा दिया गया डीएनए की सरंचना का नमूना डीएनए की द्वितीयक सरंचना को प्रदर्शित करता है।
इस नमूने के अनुसार –
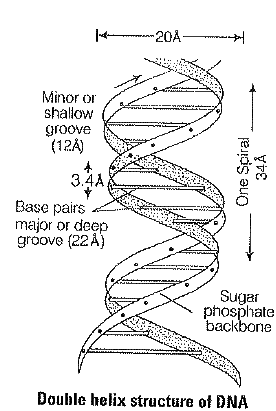
- डीएनए एक दोहरी कुंडली के रूप में पाया जाता है।
- पॉली न्यूक्लिओटाइड की दोनो लड़ियां एक दूसरे के प्रति समानांतर होती है, जो एक दूसरे की विपरीत दिशाओं में होती है।
- लड़ियों का मुख्य भाग शर्करा-फॉस्फेट-शर्करा श्रंखला से बना होता है, जिसमे नाइट्रोजन क्षार एक दूसरे की तरफ मुख किए हुए मुख्य भाग पर लगभग लंबवत प्रक्षेपित होते है।
- एक लड़ी दूसरी लड़ी से हाइड्रोजन बंध द्वारा जुड़ी रहती है।
- एडेडिन, थाइमिन के साथ दो हाइड्रोजन बंध से तथा ग्वानिन, साइटोसीन के साथ तीन हाइड्रोजन बंध से जुड़ा रहता है।
- प्रत्येक श्रंखला एक घुमावदार सीढ़ी के समान प्रतीत होती है।
- इस सीढ़ी का प्रत्येक पद क्षार युग्मों का बना होता है।
- सीढ़ी का प्रत्येक पद दूसरे पद से 360 डिग्री के कोण पर घुमा हुआ होता है।
- कुंडलित श्रंखला के एक पूर्ण घुमाव में दस पद या दस क्षार युग्म पाए जाते है।
- डीएनए में एक पूर्ण घुमाव की लंबाई 34 एंगस्ट्रॉम होती है जबकि दो क्षार युग्मों के बीच खड़ी दूरी 3.4 एंगस्ट्रॉम होती है।
- उपरोक्त वर्णित विशेषता B-DNA को प्रदर्शित करती है।
- लगभग एक दर्जन से भी अधिक प्रकार के डीएनए पाए जाते है जिनका नामकरण सरंचनात्मक विशेषता के आधार पर अंग्रेजी की वर्णमाला के आधार पर किया जाता है।
पॉलीसेकराइड
ये अम्ल अविलेय अंश में पाए जाने वाले वृहत अणु है।
ये शर्करा की लंबी श्रंखलाएं होती है जिसमे विभिन्न मोनोसेकेराइड आपस में जुड़कर पॉलीसेकेराइड का निर्माण करती है। जैसे सेलुलोज (मोनो सेकेराइड ग्लूकोज का बना एक सम बहुलक)
स्टार्च या मण्ड भी एक पॉलीसेकेराइड है जो पादप ऊतक में ऊर्जा भंडार के रूप में पाया जाता है।
ग्लाइकोजन भी एक शाखित पॉलीसेकेराइड है जो प्राणियों में ऊर्जा भंडार के रूप में पाया जाता है।
इनुलिन भी एक पॉलीसेकेराइड है जो फ्रुक्टोज का बहुलक है।
एक पॉलीसेकेराइड श्रंखला का दाहिना सिरा अपचायक सिरा और बायां सिरा अनापचायक सिरा कहलाता है।
स्टार्च में एक द्वितीयक कुंडलीदार सरंचना पाई जाती है जिसमें आयोडीन अणु इसकी कुण्डली से जुड़कर नीला रंग देता है, सेल्यूलोज में कुंडलीदार सरंचना नही पाई जाती इसलिए आयोडीन इसमें प्रवेश नहीं कर पाता इसलिए नीला रंग उत्पन्न नहीं होता हैं।
पादप कोशिका भित्ति सेल्यूलोज की बनी होती है।
कागज जो पौधो की लुगदी से बना होता है उसमे भी सेल्यूलोज होता है।
रूई के धागे भी सेल्यूलोज से बने होते है।
प्रकृति में कई सारे जटिल पॉलीसेकेराइड पाए जाते है जो अमीनो शर्करा और रासायनिक रूप से परिवर्तित शर्करा जैसे ग्लूकोसेमिन, एन एसीटाइल ग्लूकोसेमिन से मिलकर बने होते है।
आर्थोपोडा संघ के प्राणियों में बाह्यकंकाल जटिल पॉलीसेकेराइड काइटीन से मिलकर बना होता है।
जटिल पॉली सेकेराइड अधिकतर सम बहुलक होते है।
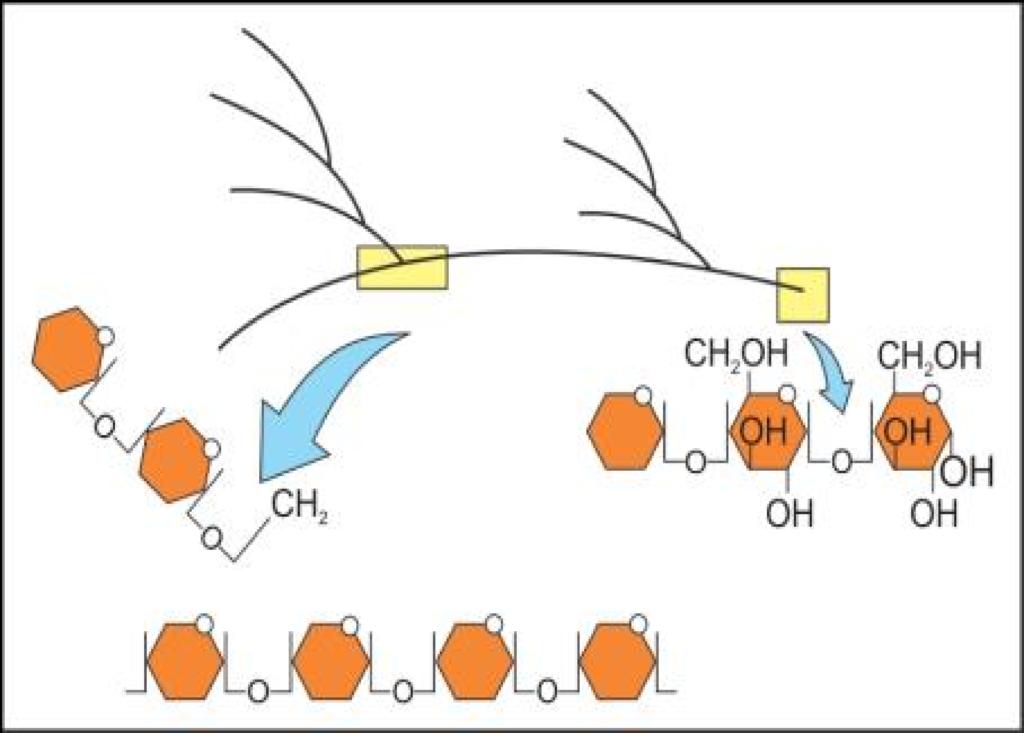
एकक बहुलक में एककों को जोड़ने वाले बंधो की प्रकृति
प्रोटीन या पॉली पेप्टाइड में अमीनो अम्ल आपस में पेप्टाइड बंध से जुड़े रहते है। पेप्टाइड बंध का निर्माण एक अमीनो अम्ल के कार्बोक्सिल समूह व अगले अमीनो अम्ल के अमीनो समूह के बीच निर्जलीकरण अभिक्रिया से होता है जिसके दौरान जल का एक अणु निकलता है।
एक पॉलीसेकेराइड में सभी मोनो सेकेराइड आपस में ग्लाइकोसाइडिक बंध से जुड़े रहते है। इस बंध के निर्माण में भी जल का एक अणु निकलता है। यह बंध दो मोनोसेकेराइड के दो कार्बन परमाणुओं के बीच बनता है।
न्यूक्लिक अम्ल में एक न्यूक्लिओटाइड के शर्करा का 3श् कार्बन अगले न्यूक्लिओटाइड की शर्करा के 5श् कार्बन से फॉस्फेट समूह द्वारा जुड़ा रहता है। शर्करा के फॉस्फेट और हाइड्राक्सिल समूह के बीच एस्टर बंध पाया जाता है। यह एस्टर बंध दोनो तरफ पाया जाता है इसलिए इसे फॉस्फोडाएस्टर बंध कहा जाता है।
प्राथमिक और द्वितीयक उपापचयज
1. प्राथमिक उपापचयज
जैव अणु जैसे अमीनो अम्ल, प्रोटीन, वसा, शर्करा आदि को प्राथमिक उपापचयज कहा जाता है।
प्राथमिक उपापचयज के सामान्य कार्यिकी क्रियाएं ज्ञात है।
प्राथमिक उपापचयज सामान्यत्या पादप और जंतु कोशिकाओं में पाए जाते है।
2. द्वितीयक उपापचयज
एल्केलाइड, फ्लेवोनॉयड्स, रबर, वाष्पशील तेल, प्रतिजैविक, रंगीन वर्णक, इत्र, गोंद, मसाले आदि द्वितीयक उपापचयज है।
द्वितीयक उपापचयज का कार्य उनको उत्पादित करने वाली कोशिकाओं या ऊतक में अज्ञात है लेकिन ये मानव कल्याण में बहुत ही उपयोगी है। कुछ द्वितीयक उपापचयज का पारिस्थितिक महत्व भी है।
द्वितीयक उपापचयज पादप, कवक और सूक्ष्म जीवों से प्राप्त किए जाते है।
द्वितीयक उपापचयज | |
वर्णक | केरोटीनॉइड्स, ऐंथोसाइनिन |
एल्केलाइड | मॉर्फिन, कोडेसिन |
टरपेनोइड्स | मोनोटर्पिन्स, डाइटरपीन्स |
आवश्यक तेल | नींबूघास तेल |
टॉक्सिन्स | एब्रिन, रिसिन |
लेक्टिंस | कोनकेनेवेलिन ए |
ड्रग्स | विनब्लास्टिन, कुरकुमीन |
बहुलक पदार्थ | रबर, गोंद, सेलुलोज |
वृहत जैव अणु
अम्ल घुलनशील अंश में पाए जाने वाले सभी पदार्थो की एक सामान्य विशेषता यह हैं की इनका अणुभार 18 से 800 डाल्टन के आस पास होता है।
अम्ल अविलेयशील अंश में चार प्रकार के कार्बनिक यौगिक पाए जाते हैं
1 प्रोटीन (10000 डाल्टन से अधिक अणुभार)
2 न्यूक्लिक अम्ल (10000 डाल्टन से अधिक अणुभार)
3 पॉलीसेकेराइड (10000 डाल्टन से अधिक अणुभार)
4 लिपिड (800 डाल्टन से कम अणु भार)
लिपिड के अतिरिक्त अम्ल अविलेयशील अंश में पाए जाने वाले सभी पदार्थ बहुलक अणु होते है।
लिपिड जिनका अणुभार 800 डाल्टन से अधिक नहीं होता तो ये अम्ल अविलेयशील अंश या वृहत आण्विक अंश की श्रेणी में क्यों आते है?
लिपिड कम अणुभार वाले यौगिक होते है जो कोशिका में कोशिका झिल्ली या अन्य झिल्लियों में पाए जाते है। जब ऊतक को अम्ल में डालकर पीसा जाता है तो कोशिकीय सरंचना विघटित हो जाती है, कोशिका झिल्ली और अन्य झिल्लियां टुकड़ों में विखंडित हो जाती है और पुटिकाओं का निर्माण करती है ये पुटिकाएँ जल में घुलनशील नहीं होती हैं, इस कारण ये पुटिका के रूप में अम्ल अविलेयशील अंश के साथ प्रथक हो जाती है जो वृहत आण्विक अंश का भाग होती है।
अम्ल विलेयशील अंश कोशिका द्रव्य का का भाग बनाते है।
कोशिका द्रव्य और कोशिका के अंगको में पाए जाने वाले वृहत अणु अम्ल अविलेयशील अंश का भाग बनाते है और उपरोक्त दोनों मिलकर जीव ऊतक का संगठन बनाते है।
कोशिका का औसत संघठन
अवयव | कुल कोशिकीय भार का प्रतिशत |
जल | 70-90 |
प्रोटीन | 10-15 |
कार्बोहाइड्रेट | 3 |
लिपिड | 2 |
न्यूक्लिक अम्ल | 5-7 |
आयन | 1 |
एंजाइम
- अधिकतर एंजाइम प्रोटीन होते है।
- कुछ न्यूक्लिक अम्ल एंजाइम की तरह कार्य करते है जैसे राइबोजाइम (catalytic RNA)
- किसी भी एंजाइम को रेखीय चित्र की सहायता से चित्रित किया जा सकता है।
- एंजाइम में भी प्रोटीन की तरह प्राथमिक सरंचना पाई जाती है जो अमीनो अम्ल की श्रंखला से मिलकर बनी होती है। एंजाइम में द्वितीयक और तृतीयक सरंचना भी पाई जाती है।
- एंजाइम की तृतीयक सरंचना में प्रोटीन श्रंखला का प्रमुख भाग कुंडलित होकर कुंडली के समान सरंचना बनाता है इन कुंडलीनुमा सरंचना में दरारे बन जाती हैं जिन्हे सक्रिय स्थल कहा जाता है।
- एंजाइम का सक्रिय स्थल वे सरंचना है जिसमे क्रियाधार आकर जुड़ जाता है और इस प्रकार एंजाइम अपने सक्रिय स्थल द्वारा अभिक्रियाओं को तेज गति से उत्प्रेरित करता है।
- एंजाइम उत्प्रेरक अकार्बनिक उत्प्रेरक से कई प्रकार से भिन्न होते है लेकिन इनमे सबसे बड़ा अंतर यह है की अकार्बनिक उत्प्रेरक उच्च ताप और उच्च दाब पर भी क्रियाशील होते है लेकिन एंजाइम अणु उच्च ताप (40 डिग्री सेल्सियस से ऊपर) पर क्षतिग्रस्त हो जाते है।
- सामान्यतया अति उच्च ताप जैसे गरम स्त्रोतों या गंघक के झरनों में पाए जाने वाले जीवों से प्राप्त एंजाइम ताप स्थाई होते है और उनकी उत्प्रेरक क्षमता उच्च ताप (80 से 90 डिग्री सेल्सियस तक) पर भी बनी रहती है। इन ताप स्थाई एंजाइम को ऊष्मा स्नेही जीवों से प्राप्त किया जाता है। जैसे जीवाणु थर्मस एक्वेटिकस से प्राप्त एंजाइम Taq DNA पॉलीमरेज।
रासायनिक अभिक्रिया
- रासायनिक यौगिक में दो तरह के परिवर्तन होते है
- भौतिक परिवर्तन – इस प्रकार के परिवर्तन में बिना रासायनिक बंध के टूटे हुए यौगिक के आकार में परिवर्तन होता है। कुछ भौतिक परिवर्तनों में द्रव्य की अवस्था में भी परिवर्तन होता है जिसे बर्फ का पिघलकर पानी में परिवर्तित होना या पानी का वाष्प में बदलना।
- रासायनिक परिवर्तन – इस प्रकार के परिवर्तन में कुछ रासायनिक बंध टूट जाते है और कुछ रासायनिक बंध नए बनते है। जैसे बेरियम हाइड्रोक्साइड गंधक के अम्ल के साथ क्रिया करके बेरियम सल्फेट और जल का निर्माण करता है।
Ba(OH)2 + H2SO4 ––––––→ BaSO4 + 2H2O
- यह एक अकार्बनिक रासायनिक अभिक्रिया है।
- स्टार्च के जल अपघटन द्वारा ग्लूकोज का बनना एक कार्बनिक रासायनिक अभिक्रिया है।
- भौतिक या रासायनिक अभिक्रिया की दर का संबंध इकाई समय में बनने वाले उत्पाद से होता है जिसे निम्न सूत्र से प्रदर्शित किया जाता है- दर = δP/ δt
- यदि दिशा निर्धारित हो तो इसी दर को वेग कहा जाता है।
- भौतिक और रासायनिक क्रियाओं कीे दर अन्य कारकों के साथ साथ तापक्रम द्वारा भी प्रभावित होती है।
- एक नियम के अनुसार प्रत्येक 10 डिग्री सेल्सियस तापक्रम के बढ़ने या घटने पर अभिक्रिया की दर क्रमशः द्विगुणित या आधी हो जाती है।
- उत्प्रेरित अभिक्रिया, अनुत्प्रेरित अभिक्रिया की अपेक्षा उच्च दर से संपन्न होती हैं।
- किसी एंजाइम द्वारा उत्प्रेरित अभिक्रिया की दर बिना उत्प्रेरण के संपन्न होने वाली अभिक्रिया से बहुत अधिक होती है।
- यह अभिक्रिया बहुत ही मंद गति से होती है जिसमे एक घंटे में कार्बोनिक अम्ल के केवल 200 अणुओं का निर्माण होता है, लेकिन उपरोक्त अभिक्रिया कोशिका द्रव्य में उपस्थित कार्बोनिक एनहाइड्रेज की उपस्थिति में अत्यंत तेज गति से होती है, जिसके कारण कार्बोनिक अम्ल के 6 लाख अणु प्रति सेकंड बनते है। अर्थात एंजाइम ने इस क्रिया की दर को लगभग 10 लाख गुना बढ़ा दिया है।
- बहुचरणीय रासायनिक अभिक्रिया में जहां प्रत्येक चरण एक ही जटिल एंजाइम या विभिन्न प्रकार के एंजाइम से उत्प्रेरित होता है उसे उपापचयी पथ कहते है।
- जैसे ग्लाइकोलाइसिस के दौरान ग्लूकोज के एक अणु से पाइरूविक अम्ल के दो अणुओं का बनना।
- ग्लाइकोलिसिस अभिक्रिया में ग्लूकोज से पाइरूविक अम्ल का निर्माण एक रासायनिक पथ द्वारा होता है जिसमे 10 विभिन्न प्रकार के एंजाइम काम में आते है।
- एक ही उपापचयी पथ एक या दो अतिरिक्त अभिक्रियों के द्वारा विभिन्न प्रकार के उपापचयी उत्पाद बनाता है।
- मनुष्य की कंकाली पेशियों में अनॉक्सी स्थिति में लैक्टिक अम्ल का निर्माण होता है जबकि ऑक्सी स्थिति में पाइरूविक अम्ल का निर्माण होता है।
- खमीर या यीस्ट में किण्वन के दौरान इसी पथ द्वारा इथेनॉल का निर्माण होता है।
एंजाइम द्वारा उच्च दर से रासायनिक रूपांतरण
- रासायनिक या उपापचयी रूपांतरण एक अभिक्रिया है जिसमे जो रसायन उत्पाद में परिवर्तित होता है उसे क्रियाधार कहते है।
- एंजाइम जो एक सक्रिय स्थल युक्त त्रिविमीय सरंचना है इस क्रियाधार को उत्पाद में बदलता है।
- अभिक्रिया के दौरान क्रियाधार सक्रिय स्थल से जुड़कर एंजाइम-क्रियाधार सम्मिश्र का निर्माण करते है। यह एक अत्यंत अल्पकालिक घटना है।
- क्रियाधार जब एंजाइम के सक्रिय स्थल से जुड़ता है तो इस अवस्था में क्रियाधार की नई सरंचना का निर्माण होता है जिसे संक्रमण अवस्था सरंचना कहते है। जिसके बनने के शीघ्र बाद ही रासायनिक बंध के टूटने या बनने के दौरान सक्रिय स्थल से उत्पाद मुक्त होता है या क्रियाधार की सरंचना उत्पाद की सरंचना में रूपांतरित हो जाती है।
- रूपांतरण का यह पथ संक्रमण अवस्था के द्वारा संपन्न होता है।
- स्थाई क्रियाधार और उत्पाद के बीच कई सारी रूपांतरित सरंचनात्मक अवस्थाएँ हो सकती है, हालाँकि बनने वाली सभी मध्यवर्ती अवस्थाएँ अस्थाई होती है। स्थायित्व का यह सम्बन्ध अणु की ऊर्जा अवस्था या सरंचना से जुड़ा हो सकता है।
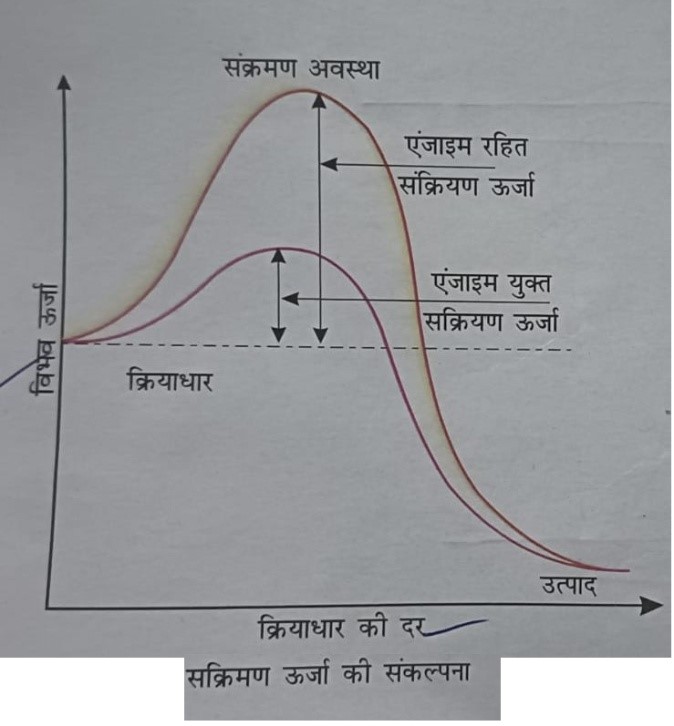
उपरोक्त ग्राफ में y अक्ष अन्तर्निहित ऊर्जा अंश को व्यक्त करता है।
x अक्ष सरंचनात्मक रूपांतरण की या वह अवस्था जिसका निर्माण मध्यवर्ती सरंचना द्वारा होता है, की प्रगति को व्यक्त करता है।
यदि उत्पाद क्रियाधार से नीचे ऊर्जा स्तर का है तो अभिक्रिया बाह्य उष्मीय होती है इस अवस्था में उत्पाद निर्माण हेतु ऊर्जा आपूर्ति की आवश्यकता नहीं होती है।
फिर भी चाहे यह बाह्य ऊष्मीय या स्वतः प्रवर्तित अभिक्रिया या अन्तः ऊष्मीय या ऊर्जा आवश्यक अभिक्रिया हो क्रियाधार को उच्च ऊर्जा अवस्था या संक्रमण अवस्था से गुजरना होता है।
क्रियाधार व संक्रमण अवस्था के बीच औसत ऊर्जा के अंतर को सक्रियण ऊर्जा कहते है।
एंजाइम ऊर्जा अवरोध को घटाकर या सक्रियण ऊर्जा को काम करके क्रियाधार से उत्पाद के आसान रूपांतरण में सहयोग करता है।
एंजाइम क्रिया की प्रकृति
प्रत्येक एंजाइम में क्रियाधार बंधन स्थल पाया जाता हैं, जो क्रियाधार के साथ बंध बनाकर सक्रिय एंजाइम-क्रियाधार सम्मिश्र का निर्माण करता है। यह सम्मिश्र अल्पावधि का होता है जो आगे चलकर उत्पाद और अपरिवर्तित एंजाइम में विघटित हो जाता है।
इससे पूर्व मध्यावस्था के रूप में एंजाइम-उत्पाद जटिल का निर्माण होता है।
एंजाइम-क्रियाधार जटिल का निर्माण उत्प्रेरण के लिए आवश्यक होता है।
एंजाइम क्रिया के उत्प्रेरण चक्र को निम्न चरणों में समझा जा सकता है-
1 सर्वप्रथम क्रियाधार एंजाइम के सक्रिय स्थल से जुड़ता है।
2 एंजाइम क्रियाधार के आकार में इस प्रकार से बदलाव करता है कि क्रियाधार एंजाइम के साथ मजबूती से बंध जाता है।
3 एंजाइम का सक्रिय स्थल अब क्रियाधार के काफी समीप होता है जिसके परिणामस्वरूप क्रियाधार के रासायनिक बंध टूट जाते है और नए एंजाइम-उत्पाद जटिल का निर्माण होता है।
4 एंजाइम नव निर्मित उत्पाद को मुक्त करता है और एंजाइम स्वतंत्र होकर क्रियाधार के नए अणु से जुड़ने के लिए पुनः तैयार हो जाता है।
एंजाइम+ क्रियाधार↔ एंजाइम-क्रियाधार जटिल → एंजाइम-उत्पाद जटिल→एंजाइम+ उत्पाद
एंजाइम क्रिया को प्रभावित करने वाले कारक
वे सभी कारक जो प्रोटीन की तृतीयक सरंचना को प्रभावित करते है, वे सभी कारक एंजाइम की सक्रियता को भी प्रभावित करते है। जैसे तापक्रम, pH आदि
क्रियाधार की सांद्रता परिवर्तन या किसी विशिष्ट रसायन के एंजाइम से बंधन, एंजाइम की प्रक्रिया को प्रभावित करता है।
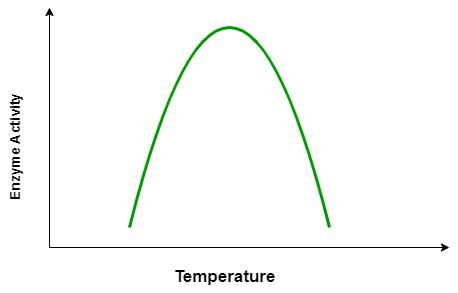
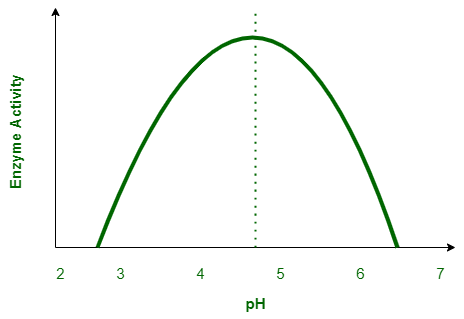
तापक्रम व pH का एंजाइम की क्रिया पर प्रभाव
सामान्यतया सभी एंजाइम सामान्य तापक्रम और pH की लघु परास में कार्य करते है।
प्रत्येक एंजाइम की अधिकतम क्रियाशीलता एक विशेष तापक्रम और विशेष pH पर होती है, जिसे क्रमशः ईष्टतम तापक्रम और ईष्टतम pH कहते है।
इस मान के ऊपर या नीचे एंजाइम की क्रियाशीलता घट जाती है।
निम्न तापक्रम एंजाइम को अस्थायी रूप से निष्क्रिय अवस्था में रखता है, जबकि उच्च तापक्रम एंजाइम की क्रियाशीलता को स्थायी रूप से नष्ट कर देता है, क्योंकि उच्च तापक्रम पर एंजाइम में उपस्थित प्रोटीन विकृत हो जाता है।
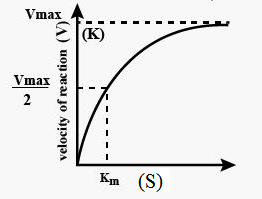
एंजाइम की क्रिया पर क्रियाधार की सांद्रता का प्रभाव
क्रियाधार की सांद्रता बढ़ने के साथ साथ पहले तो एंजाइम की गति बढ़ती है और जब अभिक्रिया अपने सर्वोच्च वेग को प्राप्त कर लेती है तो क्रियाधार की सांद्रता बढ़ने पर भी उसके वेग में कोई परिवर्तन नहीं होता है। ऐसा इसलिए होता है, क्योंकि उस समय अणुओं की संख्या क्रियाधार के अणुओं की संख्या से काफी कम होती है और इन अणुओं से एंजाइम के संतृप्त होने के बाद एंजाइम का कोई भी अणु क्रियाधार के अतिरिक्त अणुओं से बंधन करने के लिए उपस्थित नहीं होता है।
क्रियाधार की वह सांद्रता जिस पर अभिक्रिया का वेग अपने अधिकतम वेग का आधा होता है, उसे Kmकहते है।
एंजाइम की क्रिया पर विभिन्न रसायनों का प्रभाव
एंजाइम की क्रियाशीलता विशेष रसायनो से प्रभावित होती है, जो उस एंजाइम से जुड़ते है।
जब कोई रसायन एंजाइम से जुड़ने के बाद उस एंजाइम की क्रियाशीलता को खत्म कर दे तो इस क्रिया को संदमन कहते है और उस रसायन को संदमक कहा जाता है
जब संदमक अपनी आण्विक रचना में क्रियाधार से काफी समानता रखता है और एंजाइम क्रियाशीलता को संदमित करता है तो इसे प्रतिस्पर्धात्मक संदमन कहते है।
इस अवस्था में संदमक की क्रियाधार से निकटतम सरंचनात्मक समानता के कारण यह संदमक एंजाइम सक्रिय स्थल से जुड़ने के लिए क्रियाधार से प्रतिस्पर्धा करता है, जिसके कारण क्रियाधार एंजाइम के क्रियाधार बंधन स्थल से जुड़ नहीं पाता और एंजाइम की क्रिया मंद पड़ जाती है।
उदाहरण के लिए सक्सीनिक डीहाइड्रोजिनेज एंजाइम का मेलोनेट संदमक द्वारा संदमन इस अभिक्रिया में मेलोनेट रसायन क्रियाधार सक्सीनेट से निकट समानता रखता है।
ऐसे प्रतिस्पर्धी संदमको का उपयोग जीवाणु रोगजनकों के नियंत्रण हेतु किया जाता है।
एंजाइम का नामकरण और वर्गीकरण
एंजाइम क्रिया के उत्प्रेरण के आधार पर एंजाइमों को विभिन्न समूहों में वर्गीकृत किया गया है।
एंजाइम को 6 वर्गो और प्रत्येक वर्ग को 4 से 13 उपवर्गो में विभाजित किया गया है जिनका नामकरण चार अंकीय संख्या पर आधारित है।
1 ऑक्सीडोरिडक्टेजेज/डी हाइड्रोजीनेजेज – ये एंजाइम दो क्रियाधारों S औरS’ में ऑक्सी अपचयन अभिक्रिया को उत्प्रेरित करते है। जैसे –
S (अपचयित) + S’ (ऑक्सीकृत) →S(ऑक्सीकृत)+S'(अपचयित)
2 ट्रासफरेजेज – ये एंजाइम क्रियाधारो S औरS’ के बीच एक समूह (हाइड्रोजन के अतिरिक्त) के स्थानांतरण को उत्प्रेरित करते हैं। जैसे –
S-G + S’ → S + S’-G
3 हाइड्रोलेजेज – ये एंजाइम एस्टर, ईथर, पेप्टाइड, ग्लाइकोसाइडिक, कार्बन-कार्बन, कार्बन- हैलाइड या फॉस्फोरस-नाइट्रोजन बंधो का जल अपघटन करते है।
4 लायेजेज – ये एंजाइम जल अपघटन के अतिरिक्त किसी अन्य विधि द्वारा क्रियाधार से समूह को अलग करते है जिसके परिणामस्वरूप द्विबंधो का निर्माण होता है।
X-C + C-Y → X-Y + C=C
5 आइसोमरेजेज – ये एंजाइम जो प्रकाशीय ज्यामितिय व स्थितीय समावयवो के अंतर रूपांतरण को उत्प्रेरित करते है।
6 लाइगेजेज – ये एंजाइम दो यौगिकों के आपस में जुड़ने को उत्प्रेरित करते है। ये एंजाइम कार्बन-ऑक्सीजन, कार्बन-सल्फर, कार्बन-नाइट्रोजन, फॉस्फोरस-ऑक्सीजन बंधो के निर्माण को प्रेरित करते है।
सहकारक
ऐसे प्रोटीन कारक जो कुछ विशेष एंजाइम के साथ जुड़कर उसे उत्प्रेरक सक्रिय बनाते है उन्हे सहकारक कहते है।
इस स्थिति में एंजाइम के प्रोटीन भाग को एपोएंजाइम कहते है।
एंजाइम से यदि सहकारक को अलग कर दिया जाए तो उनकी उत्प्रेरण क्रियाशीलता समाप्त हो जाती है।
सहकारक तीन प्रकार के होते है-प्रोस्थेटिक समूह, सह-एंजाइम, धातु आयन।
1 प्रोस्थेटिक समूह – ये कार्बनिक यौगिक होते है जो एपोएंजाइम के साथ दृढ़तापूर्वक जुड़ते है। उदाहरण एंजाइम परऑक्सीडेज और केटेलेज जो हाइड्रोजन परऑक्साइड को ऑक्सीजन और जल में तोड़ देते है। हीम भी एक प्रोस्थेटिक समूह होता है जो एपोएंजाइम के साथ दृढ़तापूर्वक जुड़ा रहता है।
2सह-एंजाइम – ये भी कार्बनिक यौगिक होते है जो एपोएंजाइम के साथ उत्प्रेरण के दौरान अस्थाई रूप से जुड़ते है। अधिकतर सह-एंजाइम का मुख्य रासायनिक अवयव विटामिन होते है। जैसे सह-एंजाइम निकोटिनामाईड एडेनिनडाई न्यूक्लियोटाइड (NAD) निकोटिनामाईड एडेनिनडाई न्यूक्लियोटाइड फॉस्फेट (NADP) विटामिन नियासिन से जुड़े रहते है।
3 धातु आयन – कई एंजाइम की क्रियाशीलता के लिए धातु आयन की आवश्यकता होती है जो एंजाइम के सक्रिय स्थल पर पार्श्व श्रृंखला से समन्वय बंध बनाते है और ठीक इसी समय ये धातु आयन क्रियाधार से भी एक या अधिक समन्वय बंधो की सहायता से जुड़े रहते है। जैसे प्रोटीयोलाइटिक एंजाइम कार्बॉक्सी पेप्टाइडेज से जिंक एक सह कारक के रूप में जुड़ा रहता है।
